První galvanický článek na světě vyvinul Luigi Galvani. Přečtěte si o jeho historii. v tomto článkuV podstatě se jedná o dočasný zdroj elektrického proudu generovaného chemickou reakcí. Tok elektronů je generován interakcí mezi dvěma odlišnými kovy. Výsledkem je chemická energie, která se pak může využít v každodenním životě.
Koncentrační galvanický článek je zdroj proudu, který se skládá ze dvou identických kovových elektrod umístěných ve směsi solí tohoto kovu v různých koncentracích.
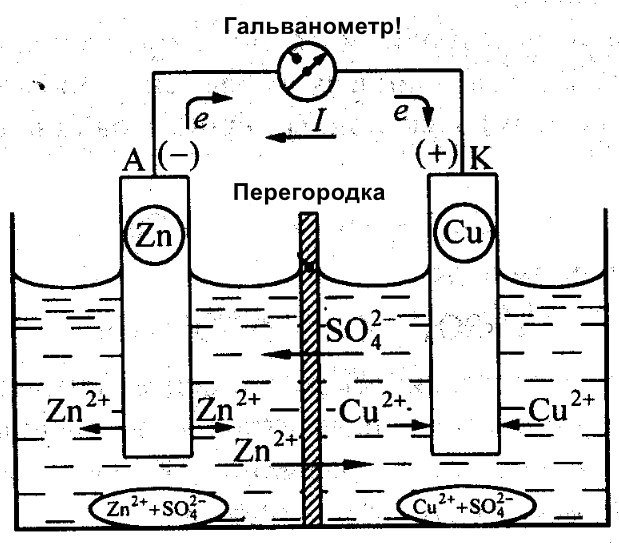
Kromě Galvaniho pracoval na vytvoření účinné baterie i Daniel Jacobi. Svůj zdroj energie mírně upravil. Skládá se z měděné destičky umístěné v CuSO4 a zinkové destičky ponořené v ZnSO4. Aby se zabránilo jejich přímé interakci, je mezi nimi umístěna porézní stěna. Níže je uveden diagram galvanického článku Daniela Jacobiho.
Zinek a měď mají odlišnou reaktivitu, a proto se bude lišit i jejich náboj. V důsledku toho nejsou ani úrovně elektrod rovnoměrné. To jim umožňuje pohybovat se a generovat elektrický nebo galvanický proud. Tento proud začne protékat, když člověk nebo vynálezce zařízení pro ukládání proudu připojí zátěž. Touto zátěží může být žárovka, rádio, počítačová myš nebo jiná elektrická zařízení.
Schéma zapojení galvanického článku
Schéma zapojení označuje jeho složení a strukturu. Může být sestaveno z několika chemických prvků pomocí pomocných zařízení. Níže bude stručně popsána struktura galvanického článku. Více se o tom dočtete v tomto článku.!
Struktura galvanického článku
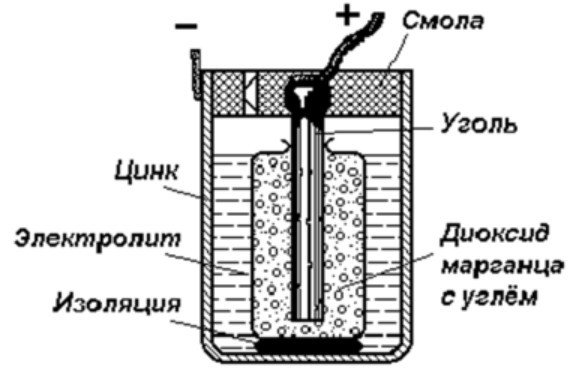
Nejjednodušší zařízení pro ukládání energie se skládá z:
- Prut uhlí.
- Dva odlišné kovy.
- Elektrolyt.
- Pryskyřice nebo plast.
- Izolátor.
Jak je vidět z tohoto diagramu, galvanický článek se skládá ze záporné a kladné elektrody. Mohou být vyrobeny z mědi, zinku nebo jiných kovů. Nazývají se měděno-zinkové články. Někdy se jim říká suché baterie.
Označení galvanického článku ve schématu Je vytvořen ve formě dvou svislých čar, blízko sebe v malé vzdálenosti. Jedna z nich bude menší. Na okrajích každé takové čáry jsou značky označující polaritaDlouhá čára je označena kladným pólem a krátká záporným. Vedle ní může být zobrazeno napětí. To znamená, že obvod využívající baterii pracuje pouze při tomto napětí.
Princip fungování galvanického článku
Galvanický článek funguje na principu pohybu elektronů z jednoho kovového kontaktu na druhý. Dochází k chemické přeměně. Přečtěte si více o termodynamice galvanického článku a vzniku galvanické elektřiny. Zde.
Odpovědi na často kladené otázky
| Galvanické | Vysvětlení |
| Baterie | Zdroj energie, který funguje na základě procesů probíhajících v uzavřeném, miniaturním prostoru. Konkrétně se energie generuje chemickou reakcí. |
| Voltaický článek nebo Voltaicova hromada | Toto je energetický prvek, který poprvé vytvořil vědec jménem Volt. |
| Proces | Interakce mezi chemickými prvky, která vede ke vzniku elektrického proudu. |
| Splnit | Toto je dokončení chemické reakce. To znamená, že mezi látkami nedojde k žádné interakci. Galvanický výboj je ve Warframe přítomen. V podstatě se jedná o modifikaci, které je nedostatkovým zbožím. Používá se pro zbraně na blízko. PolaritaV2. |
| Galvanický kontakt | Toto je kontakt mezi elektrodami a roztokem. |
| Účinek | Vzhled rozdílu mezi dvěma kontakty vyrobenými ze dvou typů kovů. Velikost závisí na teplotě a chemickém složení vodičů. V podstatě se jedná o první Voltův zákon. |
| Spojení/články/řetězy | Připojení dvou nebo více částí elektrického obvodu ke zdroji proudu. |
| Galvanický náboj | Nabíjení baterie energií. |
Galvanizace je chemický proces využívající elektrický proud. Reakce snižuje množství rozpuštěných kovových kationtů do té míry, že nakonec vytvoří na kovové elektrodě rovnoměrný povlak. Výsledkem je, že předmět se stává odolnějším, mizí drobné promáčkliny a jeho vzhled se stává atraktivnějším.
Typy galvanických článků
Existuje řada specifických typů baterií.
Tabulka galvanických článků
| Typ | Napětí | Hlavní výhody |
| Lithium | 3 V | Velký kapacita, vysoký proud. |
| Solné baterie nebo uhlík-zinek | 1,5 palce | Nejlevnější. |
| Nikl oxyhydroxyl NiOOH | 1,6 voltů | Vysoký proud. Vysoká kapacita. |
| Alkalické nebo zásadité | 1,6 V | Vysoký proud. Dobrý objem. |
Toto téma je podrobněji rozebráno v článku. typy baterií!
Účel galvanického článku
Je určen ke spouštění elektrických zařízení. Může se jednat o:
- Hodinky.
- Dálkové ovladače.
- Baterky.
- Lékařské vybavení.
- Notebooky.
- Hračky.
- Klíčenky.
- Telefony.
- Laserová ukazovátka.
- Kalkulačky.
A podobné věci kolem nás.
Galvanický článek doma
Jednoduchý zdroj energie si můžete vyrobit sami. K tomu budete potřebovat následující materiály:
- Plastový kelímek.
- Elektrolyt. Může se jednat o fyziologický roztok, sodu nebo kyselinu citronovou zředěnou ve vodě.
- Desky ze dvou různých kovů. Například hliník a měď.
- Dráty
Výrobní proces
Vezměte si plastový kelímek a nalijte do něj elektrolyt. Nenaplňujte ho až po okraj, nejlépe ho nechte 1–2 centimetry krátký. Připevněte dráty k kovovým destičkám. Poté umístěte měděné a hliníkové destičky na okraje nádoby. Měly by být vzájemně rovnoběžné. Jakmile je vše připraveno, můžete změřit napětí voltmetrem.
Připojte zařízení a dotkněte se sondami kontaktů našeho zdroje napájení. Držte je na místě, dokud se na displeji nezobrazí napětí. Obvykle se jedná o 0,5-0,7 voltu. Tyto hodnoty závisí na elektrolytu, respektive na látce použité jako elektrolyt.
Takto se vyrábí domácí galvanický článek.