Baterie funguje na principu jednoduché chemické reakce, která obvykle probíhá mezi třemi prvky. Výsledná reakce mezi těmito látkami vytváří elektrický proud. To je podstata věci.
Tři klíčové objekty:
- Anoda "+"
- Katoda "-"
- Elektrolyt
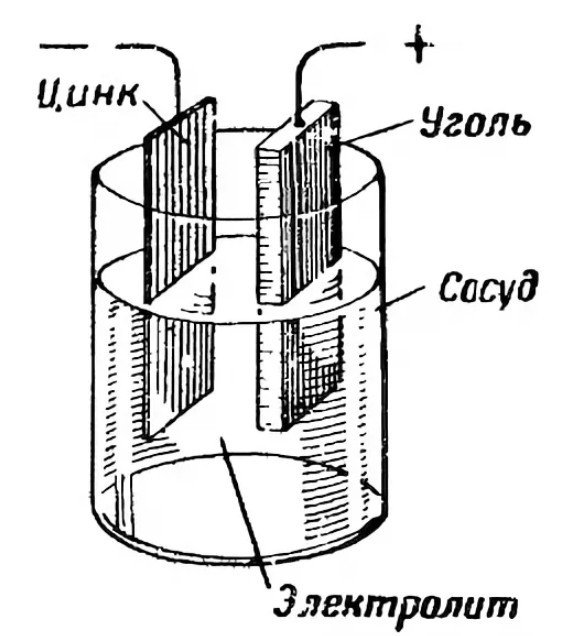
Anoda neboli kladný pól slouží jako zdroj elektronů. Obvykle je vyrobena ze zinku. Obě elektrody spolu interagují prostřednictvím elektrolytu. Elektrolyt je obvykle sůl, chlorid amonný nebo alkálie. Může být suchý nebo kapalný. Pro zahuštění látky výrobci přidávají polymerní sloučeniny. Někteří používají škrob.
Jak funguje baterie
Proud teče z kladného pólu do záporného. K tomu dochází, když je k baterii připojena zátěž. Pouhé propojení kladného a záporného pólu vodičem způsobí zkrat. To může baterii rychle vybít a dokonce způsobit požár.
Katoda funguje jako redukční činidlo, které získává elektrony z anody. V prostředí elektrolytu se ionty volně pohybují a usnadňují efektivní generování proudu.
Co se chemicky děje?
Například ve skle kapacitaNalijme roztok kyseliny sírové a vložte do něj zinkovou tyč. Na povrchu tyče jsou přítomny kladně nabité ionty. Záporné ionty látky se hromadí kolem zinkového předmětu v roztoku. Roztok vyvíjí přitažlivé síly, které snadno oddělují ionty zinku. V důsledku toho kapalina získá kladný náboj a zinková destička nebo tyč získá záporný náboj. Fyzika nám říká, že rozdíl potenciálů se rovná napětí. To je to, co generuje elektrický proud.
V důsledku toho, když se kyselý roztok a kov dostanou do kontaktu, na rozhraní vznikne elektrické pole. V tomto okamžiku se chemická energie přeměňuje na elektrickou energii. Takto funguje baterie.
Po určité době se životnost baterie vybije. Vše záleží na tom, kde a jak se zdroj energie používá. Pokud například napájí baterku, pak při mírném používání vydrží dvě 1,5voltové baterie každá měsíc. Pokud však stejné baterie vložíte do elektromobilu, pojede jen několik hodin.
V důsledku toho všeho můžeme usoudit, že čím větší je zátěž, tím rychleji se baterie vybije.
Čtěte také: